
Я создала и активно наполняю телеграм-канал "Перець". Здесь лучшие карикатуры из журнала, начиная с 1922 года.
Заходите, подписывайтесь: https://t.me/cartalana

КАБАРДИН О.Ф. "ФИЗИКА (справочные материалы)", 1991
83. ДОКАЗАТЕЛЬСТВА СЛОЖНОЙ СТРУКТУРЫ АТОМОВ
Открытие электрона. Первые экспериментальные результаты, из которых можно было сделать вывод о сложной структуре атомов, о наличии внутри атомов электрических зарядов, были получены М. Фарадеем в 1883 г. при изучении законов электролиза.
В 1897 г. Дж. Дж. Томсон в результате экспериментов по изучению электрического разряда в разреженных газах, фотоэффекта и термоэлектронной эмиссии установил, что при соударениях атомов в плазме электрического разряда, при нагревании вещества или освещении его ультрафиолетовым светом из атомов любого химического элемента вырываются одинаковые отрицательно заряженные частицы. Эти частицы были названы электронами. Электрический заряд е отдельных электронов впервые был измерен в опытах Р. Милликена в 1909 г. Он оказался действительно одинаковым у всех электронов.
Масса электрона примерно в 2000 раз меньше массы самого легкого из атомов - атома водорода. Открытие электрона и обнаружение электронов в составе атомов любого химического элемента было первым доказательством сложности атомов.
Периодический закон Менделеева. Открытие Д.И. Менделеевым в 1869 г. периодического закона поставило перед физикой вопрос о причинах повторяемости химических свойств элементов, расположенных в порядке возрастания атомной массы. Естественно было предположить, что увеличение массы атомов химических элементов связано с увеличением числа частиц, входящих в их состав. Периодическую повторяемость химических свойств элементов в таблице Д.И. Менделеева можно рассматривать как свидетельство периодической повторяемости основных особенностей внутренней структуры атомов по мере увеличения числа частиц, входящих в их состав.
Линейчатые спектры. Важным фактором, свидетельствующим о сложной внутренней структуре атомов, было открытие линейчатых спектров. Исследования показали, что при нагревании до высокой температуры пары любого химического элемента испускают свет, узкий пучок которого разлагается призмой на несколько узких пучков света различного цвета. Совокупность наблюдаемых при этом разноцветных линий называется линейчатым спектром испускания. Линейчатый спектр испускания каждого химического элемента не совпадает со спектром испускания ни одного другого химического элемента.
Каждая отдельная линия в линейчатом спектре излучения образуется светом с одной длиной волны. Следовательно, источник света с линейчатым спектром излучения испускает электромагнитные волны не со всевозможными частотами, а только с несколькими вполне определенными  .
.
При пропускании белого света со сплошным спектром через пары вещества наблюдается возникновение темных линий на фоне сплошного спектра испускания. Темные линии расположены точно в тех местах, в которых наблюдаются светлые линии спектра излучения данного химического элемента. Такой спектр называется линейчатым спектром поглощения.
Линейчатые спектры поглощения свидетельствуют о том, что вещество в газообразном состоянии способно поглощать электромагнитное излучение только с такими частотами  , какие имеются в линейчатом спектре излучения данного вещества.
, какие имеются в линейчатом спектре излучения данного вещества.
Свет с линейчатым спектром излучения испускается веществом в газообразном атомарном состоянии при невысоких давлениях, т.е. при условии слабого взаимодействия атомов между собой. При таких условиях испускание квантов электромагнитного излучения является результатом процессов, происходящих внутри отдельных атомов.
После открытия электрона стала очевидной связь явлений излучения и поглощения света с наличием в них электронов. Действительно, свет - это электромагнитные волны. Излучение электромагнитных волн происходит при ускоренном движении электрических зарядов. Можно предположить, что при соударениях атомов электроны, имеющиеся внутри атомов, могут приобретать избыток энергии и затем излучать электромагнитные волны, совершая гармонические колебания внутри атомов. Различным длинам волн излучаемого света соответствуют различные частоты колебаний электронов внутри атомов. Следовательно, теория строения атома должна дать способы расчета длин волн в спектре любого химического элемента.
Радиоактивность. Еще одним доказательством сложности строения атомов явилось открытие явления радиоактивности. В 1896 г. французский физик Анри Беккерель (1852-1908) производил опыты с солями урана. Он установил, что атомы урана испускают невидимые глазом излучения, способные проникать через бумагу или картон и вызывать почернение фотографической пластинки.
Явление испускания атомами невидимых проникающих излучений назвали радиоактивностью (от слова "радиус" - луч).
Польского происхождения физик Мария Склодовская-Кюри (1867-1934) и французский физик Пьер Кюри (1859-1906) доказали, что радиоактивные излучения испускаются не только атомами урана, но и атомами некоторых других элементов. По радиоактивному излучению ими были открыты два неизвестных ранее химических элемента - радий и полоний.
Исследования радиоактивного излучения показали, что радиоактивные атомы испускают не один, а три вида излучения различной физической природы. Эти излучения были названы альфа-, бета- и гамма-лучами. Альфа-лучи оказались потоком ионов гелия, бета-лучи - потоком электронов, а гамма-лучи - потоком квантов электромагнитного излучения с очень малой длиной волны, порядка 10-11-10-13 м.
В результате радиоактивного распада, как впервые доказали в 1902 г. английские ученые Эрнест Резерфорд (1871-1937) и Фредерик Содди (1877-1956), происходит превращение атомов одного химического элемента в атомы другого химического элемента. Например, атом урана в результате радиоактивного распада превращается в два атома - атом тория и атом гелия. Открытие явления радиоактивного распада доказывало сложность внутренней структуры атомов, опровергало представление о неизменности, неразрушимости атомов.
Опыты по рассеянию альфа-частиц. Большие успехи в исследовании структуры атомов были достигнуты в опытах Резерфорда по изучению рассеяния быстрых заряженных частиц при прохождении через тонкие слои вещества. В этих опытах узкий пучок альфа-частиц, испускаемых радиоактивным веществом 1, направлялся на тонкую металлическую пластинку 2. За пластиной помещался экран 3, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц (рис. 302). Было обнаружено, что большинство альфа-частиц отклоняется от прямолинейного пути на углы не более 1-2°. Однако небольшая доля альфа-частиц испытывала отклонение на значительно большие углы.
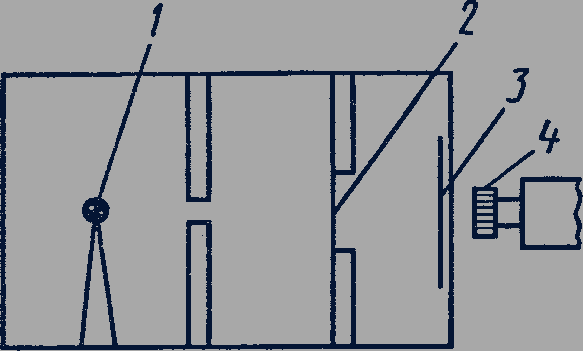
Рис. 302
Модель атома Резерфорда. Рассеяние отдельных альфа-частиц на большие углы Резерфорд объяснил тем, что положительный заряд в атоме не распределен равномерно в шаре радиусом 10-10 м, как предполагали ранее, а сосредоточен в центральной части атома в области значительно меньших размеров. В этой центральной положительно заряженной части атома - атомном ядре - сосредоточена и почти вся масса атома. Расчеты Резерфорда показали, что для объяснения опытов по рассеянию альфа-частиц нужно принять радиус атомного ядра равным примерно 10-15 м.
Резерфорд предположил, что атом устроен подобно планетной системе. Как вокруг Солнца на больших расстояниях от него обращаются планеты, так электроны в атоме обращаются вокруг атомного ядра. Радиус круговой орбиты самого далекого от ядра электрона и есть радиус атома. Такая модель атома была названа планетарной моделью.
Планетарная модель атома объясняет основные закономерности рассеяния заряженных частиц.
Так как большая часть пространства в атоме между атомным ядром и обращающимися вокруг него электронами пуста, быстрые заряженные частицы могут почти свободно проникать через довольно значительные слои вещества, содержащие несколько тысяч слоев атомов.
При столкновениях с отдельными электронами быстрые заряженные частицы испытывают рассеяние на очень небольшие углы, так как масса электрона мала. Однако в тех редких случает, когда быстрая заряженная частица пролетает на очень близком расстоянии от одного из атомных ядер, под действием сильного электрического поля атомного ядра может произойти рассеяние заряженной частицы на любой угол до 180° (рис. 303).
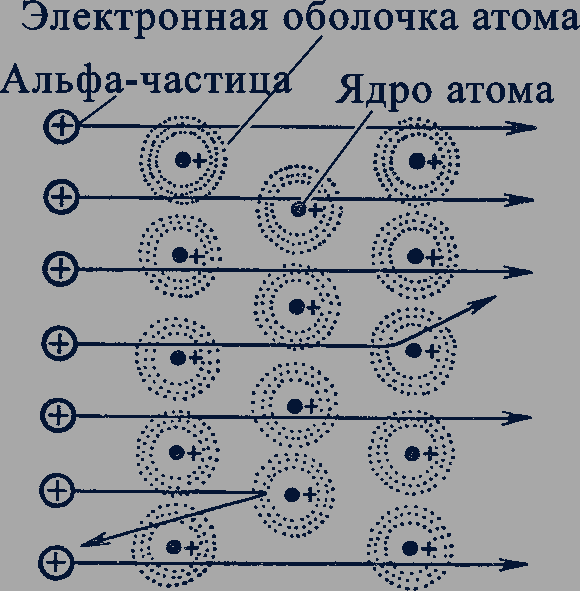
Рис. 303
Неустойчивость атома Резерфорда. Планетарная модель атома позволила объяснить результаты опытов по рассеянию альфа- частиц вещества, но встретилась с другой принципиальной трудностью.
Как известно, любое ускоренное движение электрических зарядов сопровождается излучением электромагнитных волн. Движение по окружности является ускоренным движением, поэтому электрон в атоме должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Это должно приводить к уменьшению энергии электрона, постепенному его приближению к атомному ядру и, наконец, падению на ядро. Таким образом, атом, состоящий из атомного ядра и обращающихся вокруг него электронов, согласно законам классической физики неустойчив. Он может существовать лишь короткое время, за которое электроны израсходуют всю свою энергию на излучение и упадут на ядро. Но в действительности атомы устойчивы.
Квантовые постулаты Бора. Первый шаг на пути разрешения противоречий между теорией и результатами эксперимента в физике атома был сделан датским физиком Нильсом Бором (1885-1962). Свои представления об особых свойствах атомов Бор сформулировал в виде постулатов следующего содержания:
1. Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия 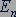 ; в стационарном состоянии атом не излучает.
; в стационарном состоянии атом не излучает.
2. При переходе атома из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения. Энергия фотона равна разности энергий атома в двух стационарных состояниях:
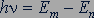 ,
,
где 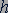 - постоянная Планка.
- постоянная Планка.
Различные возможные стационарные состояния атома, образованного из атомного ядра и электрона, определяются по Бору соотношением
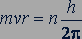 (84.1)
(84.1)
где 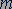 - масса электрона;
- масса электрона;  - его скорость;
- его скорость;  - радиус круговой орбиты;
- радиус круговой орбиты;  - целое число;
- целое число; 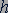 - постоянная Планка.
- постоянная Планка.
Все стационарные состояния, кроме одного, являются стационарными лишь условно. Бесконечно долго каждый атом может находиться лишь в стационарном состоянии с минимальным запасом энергии. Это состояние атома называется основным. Все остальные стационарные состояния атома называются возбужденными.
В результате соударения с другим атомом, с заряженной частицей или при поглощении фотона атом может перейти из стационарного состояния с меньшим запасом энергии в стационарное состояние с большим запасом энергии. Из любого возбужденного состояния атом самопроизвольно может переходить в основное состояние; этот переход сопровождается излучением фотонов. Время жизни атомов в возбужденных состояниях обычно не превышает 10-8-10-7 с.
Основное изменение, внесенное в физику атома постулатами Бора, заключалось в отказе от представлений о непрерывности изменения всех физических величин и в принятии идеи квантования физических величин, которыми описывается внутреннее состояние атома. Вместо непрерывного изменения расстояний между ядром и электроном в атоме оказывается возможным только дискретный ряд значений таких расстояний. Дискретными оказываются возможные значения кинетической и потенциальной энергии электрона в атоме, скорости его движения по круговой орбите.
Стационарные орбиты и энергетические уровни. На основании постулатов Бора можно наглядно представить стационарные состояния атома следующим образом.
Центростремительное ускорение  при движении электрона по окружности создается кулоновской силой
при движении электрона по окружности создается кулоновской силой 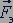 . Следовательно,
. Следовательно,
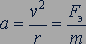
В атоме водорода заряд ядра равен заряду  электрона, поэтому для атома водорода получим:
электрона, поэтому для атома водорода получим:
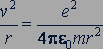
откуда
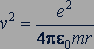 (84.2)
(84.2)
С другой стороны, скорость  движения электрона и радиус
движения электрона и радиус  его круговой орбиты связаны условием (84.1).
его круговой орбиты связаны условием (84.1).
Из выражений (84.1) и (84.2) следует, что движение электрона в атоме возможно лишь по стационарным круговым орбитам, радиусы которых определяются выражением
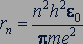
где  - целое число;
- целое число; 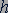 - постоянная Планка;
- постоянная Планка; 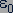 - электрическая постоянная вакуума;
- электрическая постоянная вакуума; 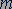 - масса электрона;
- масса электрона;  - элементарный электрический заряд.
- элементарный электрический заряд.
Подставляя в последнее выражение значения 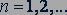 , можно вычислить радиусы первой, второй и всех последующих стационарных круговых орбит электронов в атоме.
, можно вычислить радиусы первой, второй и всех последующих стационарных круговых орбит электронов в атоме.
Двигаясь по каждой из разрешенных стационарных круговых орбит, электрон обладает определенным запасом кинетической энергии, а также и потенциальной энергией в электрическом поле атомного ядра. Обозначим через 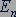 сумму кинетической энергии электрона на стационарной орбите с номером
сумму кинетической энергии электрона на стационарной орбите с номером  и потенциальной энергии взаимодействия электрона с атомным ядром. Тогда каждой разрешенной стационарной орбите электрона в атоме можно поставить в соответствие значение энергии атома в стационарном состоянии. Для наглядного представления возможных энергетических состояний атомов используются энергетические диаграммы.
и потенциальной энергии взаимодействия электрона с атомным ядром. Тогда каждой разрешенной стационарной орбите электрона в атоме можно поставить в соответствие значение энергии атома в стационарном состоянии. Для наглядного представления возможных энергетических состояний атомов используются энергетические диаграммы.
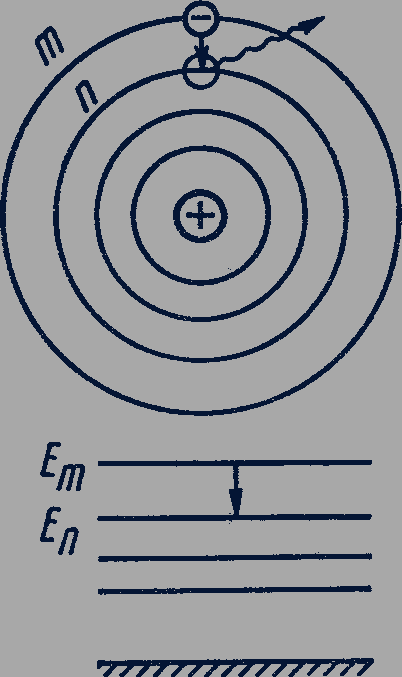 На энергетической диаграмме каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем. Ниже всех остальных на диаграмме располагается энергетический уровень, соответствующий энергии
На энергетической диаграмме каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем. Ниже всех остальных на диаграмме располагается энергетический уровень, соответствующий энергии 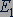 основного состояния атома, энергетические уровни возбужденных состояний располагаются над основным уровнем на расстояниях, пропорциональных разности энергий возбужденного и основного состояний. Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на энергетической диаграмме, направление перехода указывается стрелкой.
основного состояния атома, энергетические уровни возбужденных состояний располагаются над основным уровнем на расстояниях, пропорциональных разности энергий возбужденного и основного состояний. Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на энергетической диаграмме, направление перехода указывается стрелкой.
Рис. 304
Переходу электрона со стационарной орбиты под номером 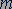 на стационарную орбиту под номером
на стационарную орбиту под номером  (рис. 304) соответствует переход атома из состояния с энергией
(рис. 304) соответствует переход атома из состояния с энергией 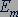 в состояние с энергией
в состояние с энергией 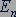 . Этот переход на диаграмме энергетических уровней обозначается вертикальной стрелкой от уровня
. Этот переход на диаграмме энергетических уровней обозначается вертикальной стрелкой от уровня 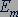 к уровню
к уровню 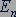 .
.
Объяснение происхождения линейчатых спектров. Постулаты Бора позволяют объяснить происхождение линейчатых спектров излучения и поглощения, связывая их существование с наличием дискретного ряда энергетических состояний атомов.
Все атомы одного химического элемента обладают одинаковым зарядом атомного ядра. При одинаковом заряде ядра атомы обладают одинаковым строением электронных оболочек и потому имеют одинаковый набор возможных энергетических состояний и переходов между ними. Излучение и поглощение фотонов происходит при переходах атомов из одного разрешенного стационарного состояния в другое. Энергия фотона, поглощаемого атомом при переходе из нормального состояния с энергией 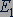 в возбужденное состояние с энергией
в возбужденное состояние с энергией 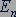 , в точности равна энергии фотона, излучаемого атомом при обратном переходе, так как и в том, и в другом случае она равна разности энергий атома в этих двух состояниях:
, в точности равна энергии фотона, излучаемого атомом при обратном переходе, так как и в том, и в другом случае она равна разности энергий атома в этих двух состояниях:
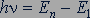 .
.
Опыт Франка и Герца. Согласно теории Бора электрон, обращающийся вокруг ядра, не может изменять свою энергию плавно, постепенно. Минимальная энергия, которую может получить атом при переходе из основного состояния в возбужденное в результате взаимодействия с другим атомом или электроном, равна разности энергий атома в основном и первом возбужденном состояниях.
Взаимодействие атома с электроном или другой частицей, в результате которого часть кинетической энергии частицы превращается в энергию возбуждения атома, называется неупругим столкновением.
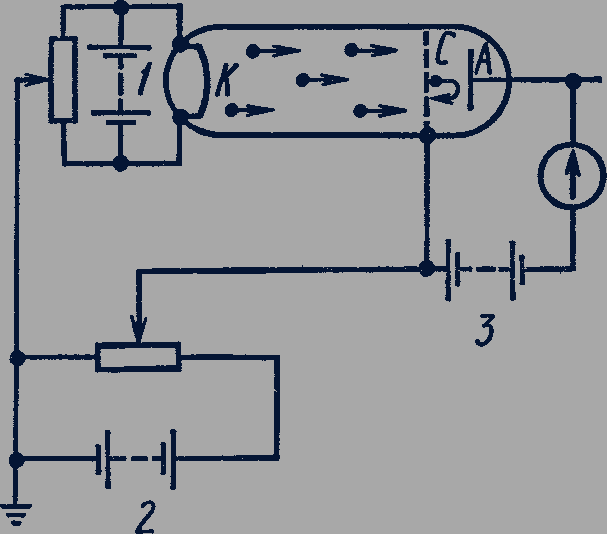
Рис. 305
Впервые неупругие столкновения электронов с атомами ртути были обнаружены в опытах немецких физиков Джеймса Франка (1882-1964) и Густава Герца (1887-1975) в 1913 г. В этих опытах применялась стеклянная трубка, заполненная парами ртути (рис. 305). Катод 𝐾 нагревается электрическим током от батареи 1. Электроны, вылетевшие из катода, ускоряются электрическим полем между катодом 𝐾 и сеткой 𝐶, создаваемым батареей 2. Их кинетическая энергия при достижении сетки равна работе электрического поля:
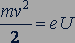
где  - заряд электрона,
- заряд электрона, 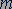 - его масса;
- его масса; 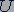 - напряжение, создаваемое батареей 2;
- напряжение, создаваемое батареей 2;  - конечная скорость электрона.
- конечная скорость электрона.
Опыты показали, что передача энергии от электронов к атомам ртути наблюдается, лишь когда энергия электронов достигает значения 4,9 эВ. При меньших значениях энергии происходят только упругие столкновения электронов с атомами ртути; при этих столкновениях электроны не передают энергию атомам ртути.
Пока напряжение между катодом и сеткой было меньше 4,9 В, свечение паров ртути в трубке не наблюдалось, при достижении напряжения 4,9 В пары ртути начинают излучать свет с частотой 1,2·1015 с-1. Это значение совпадает со значением, вычисленным по формуле
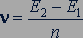 ,
,
где 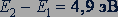 .
.
Опыты Франка и Герца явились экспериментальным подтверждением правильности основных положений квантовой теории Бора.
Одним из самых замечательных достижений физики второй половины двадцатого века было открытие физических явлений, послуживших основой для создания удивительного прибора - оптического квантового генератора, или лазера.
Физической основой работы лазера служит явление индуцированного излучения.
Спонтанное и индуцированное излучения. Излучение, испускаемое при самопроизвольном переходе атома из одного состояния в другое, называется спонтанным излучением. Спонтанное излучение различных атомов происходит некогерентно, так как каждый атом начинает и заканчивает излучение независимо от других.
В 1916 г. А. Эйнштейн предсказал, что переходы электрона в атоме с верхнего энергетического уровня на нижний с испусканием излучения могут происходить под влиянием внешнего электромагнитного поля. Такое излучение называют вынужденным или индуцированным.
Вероятность индуцированного излучения резко возрастает при совпадении частоты электромагнитного поля с собственной частотой излучения возбужденного атома.
Таким образом, в результате взаимодействия возбужденного атома с фотоном получаются два совершенно одинаковых по энергии и направлению движения фотона-близнеца (рис. 306).
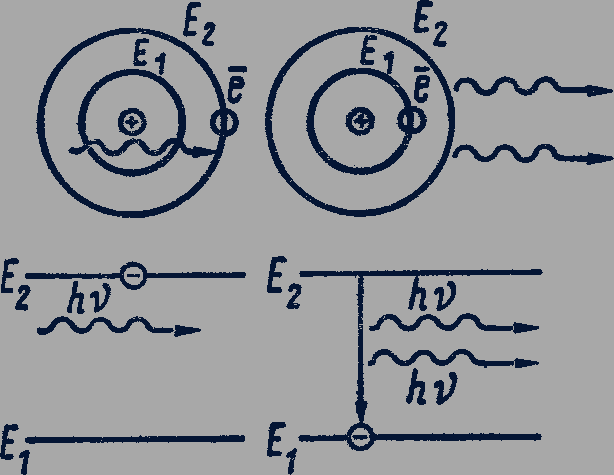
Рис. 306
С точки зрения волновой теории атом излучает электромагнитную волну, совершенно одинаковую по направлению распространения, частоте, фазе и поляризации с той, которая вынудила атом излучать. В итоге получается результирующая волна с амплитудой большей, чем у падающей. Особенностью индуцированного излучения является то, что оно монохроматично и когерентно. Это свойство положено в основу устройства лазеров.
При прохождении света через вещество происходит поглощение фотонов атомами и индуцированное излучение фотонов атомами, находящимися в возбужденном состоянии. Для того чтобы мощность светового излучения увеличивалась после прохождения через вещество, в веществе больше половины атомов должны находиться в возбужденном состоянии. Состояния вещества, в которых меньше половины атомов находится в возбужденном состоянии, называются состояниями с нормальной населенностью энергетических уровней (рис. 307,а). Состояния вещества, в которых больше половины атомов находится в возбужденном состоянии, называются состояниями с инверсной (от лат. inversio - переворачиваю) населенностью уровней (рис. 307,б). В веществе с инверсной населенностью уровней возбужденных атомов больше, чем невозбужденных; поэтому чаще должны происходить процессы индуцированного излучения фотонов, чем их поглощения. В результате при прохождении света через вещество с инверсной населенностью уровней должно происходить усиление потока света, а не ослабление. Это явление было открыто экспериментально в 1951 г. советскими физиками В.А. Фабрикантом, М.М. Вудынским, Ф.А. Бутаевой.
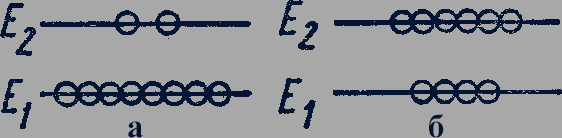
Рис. 307
Оптический квантовый генератор-лазер. Система атомов с инверсной населенностью уровней способна не только усиливать, но и генерировать электромагнитное излучение. Для работы в режиме генератора необходима положительная обратная связь, при которой часть сигнала с выхода устройства подается на его вход. Для этого активная среда, в которой создается инверсная населенность уровней, располагается в резонаторе, состоящем из двух параллельных зеркал. В результате одного из спонтанных переходов атома с верхнего уровня на нижний возникает фотон.
При движении в сторону одного из зеркал он вызывает индуцированное излучение, и к зеркалу подходит целая лавина фотонов. После отражения от зеркала лавина фотонов движется в противоположном направлении, попутно заставляя высвечиваться все новые возбужденные атомы; процесс продолжается до тех пор, пока существует инверсная населенность уровней.
Рассмотренный принцип усиления и генерации электромагнитного излучения был предложен советскими физиками Н.Г. Басовым, А.М. Прохоровым и одновременно американским физиком Ч. Таунсом. За работы в этой области Н.Г. Басов и А.М. Прохоров удостоены Ленинской премии в 1959 г., и вместе с Ч. Таунсом в 1964 г. им присуждена Нобелевская премия.
В первых лазерах активной средой был кристалл рубина (AI2O3) с примесью около 0,05% хрома (рис. 308). Этот основной элемент лазера обычно имеет форму цилиндра 1 диаметром 0,4-2 см и длиной 3-20 см. Торцы цилиндра 3 и 4 строго параллельны, на них нанесен слой серебра. Одна из зеркальных поверхностей частично прозрачна: 92% светового потока отражается от нее и около 8% светового потока пропускается ею.
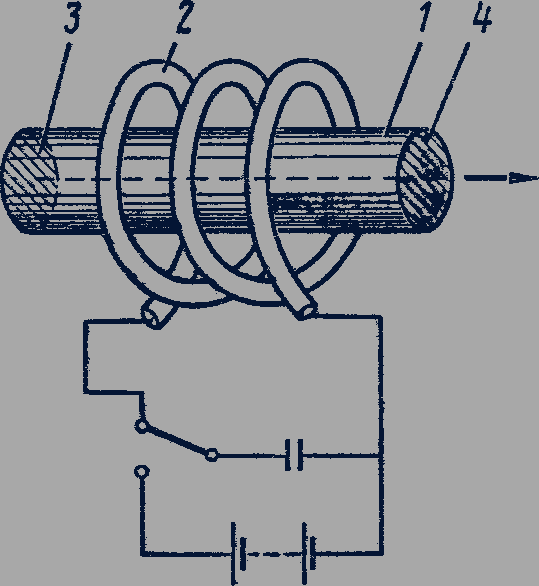
Рис. 308
Рубиновый стержень помещен внутри импульсной спиральной лампы 2, являющейся источником возбуждающего излучения. Атомы хрома, поглощая излучение длиной волны 560 нм, содержащееся в спектре излучения лампы, переходят с основного уровня на второй возбужденный уровень. Время жизни атомов хрома на втором возбужденном уровне мало. Большая часть возбужденных атомов совершает переходы на первый возбужденный уровень. Этот уровень является метастабильным, т.е. в этом состоянии атомы находятся дольше, чем в обычном возбужденном состоянии.
Если мощность лампы-вспышки достаточно велика, то населенность метастабильного уровня окажется больше, чем населенность основного уровня. Процесс создания инверсной населенности называют накачкой, соответственно используемую для этого лампу называют лампой накачки.
Достаточно одному атому хрома совершить спонтанный переход с метастабильного уровня на основной с испусканием фотона, как возникает лавина фотонов, вызванная индуцированным излучением атомов хрома, находящихся в метастабильном состоянии. Если направление движения первичного фотона строго перпендикулярно плоскости зеркала на торце рубинового цилиндра, то первичные и вторичные фотоны отражаются от первого зеркала и летят через кристалл до второго зеркала. На своем пути они вызывают вынужденное излучение у новых атомов хрома, и процесс продолжается. Процесс высвечивания всех возбужденных атомов хрома завершается за 10-8 - 10-10 с. Мощность светового излучения лазера при этом может быть более 109 Вт, т.е. превышать мощность крупной электростанции.
В настоящее время, кроме лазеров на кристаллах, разработаны газовые лазеры и лазеры на жидкостях.
Основными особенностями лазерного излучения являются его когерентность, возможность получения световых пучков с очень малой расходимостью, возможность получения потоков излучения с очень большой мощностью.
Луч лазера может прожечь отверстие в самом твердом материале, расплавить любую металлическую броню, и он же помогает хирургам при выполнении самых тонких операций внутри человеческого глаза. По лучу лазера осуществляется телефонная связь и прокладка трасс, лазер применяется для измерения расстояний и для получения объемных изображений предметов - голограмм.
В ряде стран ведутся разработки лазерного оружия для применения его в космическом пространстве. Советский Союз и другие социалистические страны выступают за прекращение разработки любых новых видов оружия массового уничтожения, против использования космического пространства в военных целях.
Заряд ядра. Точные измерения электрического заряда атомных ядер были выполнены в 1913 г. английским физиком Генри Мозли (1887-1915). Заряды ядер атомов различных химических элементов он определил по спектрам рентгеновского излучения, испускаемого атомами при облучении вещества потоком электронов высокой энергии. Мозли установил, что электрический заряд ядра атома равен произведению элементарного электрического заряда  на порядковый номер
на порядковый номер  химического элемента в таблице Менделеева:
химического элемента в таблице Менделеева:
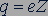 .
.
Таким образом, порядковый номер химического элемента в таблице Менделеева определяется числом положительных элементарных зарядов в ядре любого атома химического элемента или числом электронов в оболочке нейтрального атома.
Нейтрон. Так как ядро атома химического элемента с порядковым номером  в таблице Менделеева содержит
в таблице Менделеева содержит  элементарных положительных зарядов, то естественно было предположить, что ядро любого из атомов этого химического элемента составлено из
элементарных положительных зарядов, то естественно было предположить, что ядро любого из атомов этого химического элемента составлено из  одинаковых частиц, каждая из которых обладает элементарным положительным зарядом. Такой частицей мог быть протон - ядро самого легкого из атомов - атома водорода. Протон обладает положительным элементарным зарядом, масса
одинаковых частиц, каждая из которых обладает элементарным положительным зарядом. Такой частицей мог быть протон - ядро самого легкого из атомов - атома водорода. Протон обладает положительным элементарным зарядом, масса 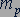 протона равна 1,6726·10-27 кг. Если бы атомные ядра состояли только из протонов, то ядро атома химического элемента с порядковым номером
протона равна 1,6726·10-27 кг. Если бы атомные ядра состояли только из протонов, то ядро атома химического элемента с порядковым номером 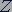 должно было обладать электрическим зарядом
должно было обладать электрическим зарядом 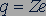 и массой
и массой 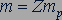 . Но в действительности масса, например, ядра атома кислорода не в 8 раз больше массы ядра атома водорода, а примерно в 16 раз.
. Но в действительности масса, например, ядра атома кислорода не в 8 раз больше массы ядра атома водорода, а примерно в 16 раз.
Проблема состава атомного ядра была решена только после открытия английским физиком Джеймсом Чедвиком (1891-1974) в 1932 г. частицы, не имеющей электрического заряда и обладающей массой, примерно равной массе протона. Эту частицу назвали нейтроном.
Состав атомных ядер. После открытия нейтрона советский физик Дмитрий Дмитриевич Иваненко и немецкий физик Вернер Гейзенберг (1901-1976) выдвинули гипотезу о протонно-нейтронном строении ядра. Согласно, этой гипотезе все ядра состоят из протонов и нейтронов. Число протонов в ядре равно порядковому номеру элемента в таблице Менделеева и обозначается знаком 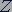 . Число нейтронов в ядре обозначается знаком
. Число нейтронов в ядре обозначается знаком 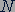 . Общее число протонов и нейтронов в ядре обозначается знаком
. Общее число протонов и нейтронов в ядре обозначается знаком 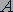 и называется массовым числом.
и называется массовым числом.
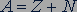 .
.
Изотопы. Ядра с одинаковым числом протонов, но различным числом нейтронов являются ядрами различных изотопов одного химического элемента. Из-за разного числа нейтронов ядра различных изотопов одного химического элемента обладают разными массами и могут отличаться по физическим свойствам, например по способности к радиоактивному распаду. Из-за одинакового заряда ядра атомы разных изотопов одного химического элемента имеют одинаковое строение электронных оболочек и поэтому обладают одинаковыми химическими свойствами.
Обозначается изотоп символом химического элемента 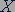 с указанием слева вверху массового числа
с указанием слева вверху массового числа 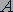 и слева внизу числа протонов
и слева внизу числа протонов 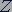 в атомном ядре:
в атомном ядре:
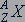 .
.
Например, самый легкий изотоп водорода, ядром которого является один протон, обозначается символом 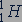 . Тяжелый изотоп водорода - дейтерий, ядро которого содержит один протон и один нейтрон, обозначается символом
. Тяжелый изотоп водорода - дейтерий, ядро которого содержит один протон и один нейтрон, обозначается символом 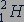 .
.
⇦ Ctrl предыдущая страница / следующая страница Ctrl ⇨
МЕНЮ САЙТА / СОДЕРЖАНИЕ