
Я создала и активно наполняю телеграм-канал "Перець". Здесь лучшие карикатуры из журнала, начиная с 1922 года.
Заходите, подписывайтесь: https://t.me/cartalana

КАБАРДИН О.Ф. "ФИЗИКА (справочные материалы)", 1991
22. ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ И ИХ ОПЫТНОЕ ОБОСНОВАНИЕ
Развитие представлений о строении вещества. Предположение о том, что любое вещество состоит из мельчайших неделимых частиц - атомов, было высказано около 2500 лет назад древнегреческими философами Левкиппом и Демокритом. По их представлениям все тела образуются в результате соединения атомов. Различия в свойствах тел объясняются тем, что тела состоят из различных атомов или одинаковые атомы по-разному соединены между собой в пространстве.
Работы М.В. Ломоносова. Существенный вклад в развитие молекулярно-кинетических представлений сделал в середине XVIII в. великий русский ученый Михаил Васильевич Ломоносов (1711-1765). Он объяснил основные свойства газа, предположив, что все молекулы газа движутся беспорядочно, хаотично и при столкновениях отталкиваются друг от друга. Беспорядочным движением молекул М.В. Ломоносов впервые объяснил природу теплоты. Так как скорости теплового движения молекул могут быть сколько угодно велики, температура вещества по его представлениям не имеет ограничения сверху. При уменьшении скорости молекул до нуля должно быть достигнуто минимальное возможное значение температуры вещества. Объяснение природы теплоты движением молекул и вывод о существовании абсолютного нуля температуры, сделанный М.В. Ломоносовым, получили теоретическое и экспериментальное подтверждение в конце XIX в.

Рис. 78
Основные положения молекулярно-кинетической теории. Молекулярно-кинетической теорией называется учение о строении и свойствах вещества, использующее представления о существовании атомов и молекул как наименьших частиц химического вещества.
Способность газов неограниченно расширяться, упругость газов, жидкостей ж твердых тел, способность к взаимному проникновению тел путем диффузии можно объяснить, если принять следующие положения молекулярно-кинетической теории строения вещества: вещество состоит из частиц - атомов и молекул; эти частицы хаотически движутся; частицы взаимодействуют друг с другом.
Движение атомов и молекул, их взаимодействия подчиняются законам механики. Это позволяет использовать законы механики для выяснения свойств тел, состоящих из большого числа хаотически движущихся малых частиц.
Взаимодействие атомов и молекул. При сближении двух атомов или молекул сначала преобладают силы притяжения. Но на некотором расстоянии  между их центрами силы отталкивания возрастают настолько, что становятся равными по модулю силам притяжения. При дальнейшем сближении силы отталкивания превосходят силы притяжения (рис. 77). Силы притяжения между атомами и молекулами препятствуют растяжению твердого тела, силы отталкивания препятствуют его сжатию.
между их центрами силы отталкивания возрастают настолько, что становятся равными по модулю силам притяжения. При дальнейшем сближении силы отталкивания превосходят силы притяжения (рис. 77). Силы притяжения между атомами и молекулами препятствуют растяжению твердого тела, силы отталкивания препятствуют его сжатию.
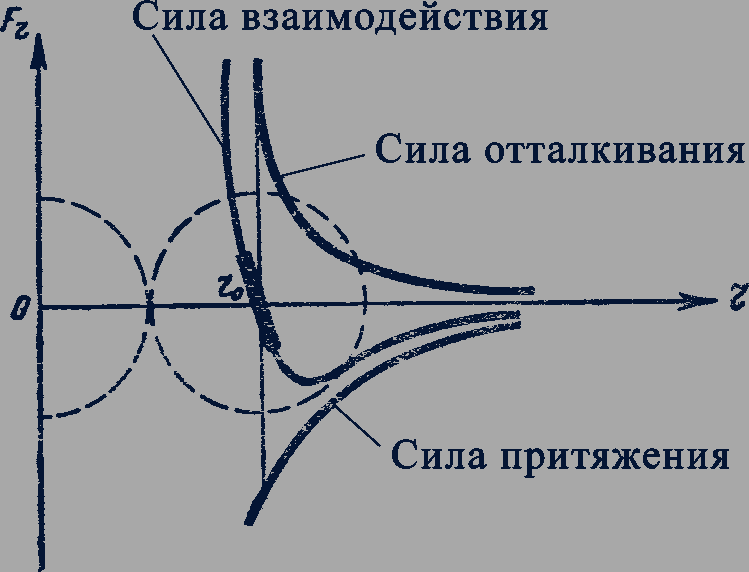
Рис. 77
Действие сил молекулярного притяжения обнаруживается в опыте со свинцовыми цилиндрами, слипающимися после очистки их поверхностей (рис. 78).
Тепловое движение молекул. Молекулы и атомы в твердом теле совершают беспорядочные колебания относительно положений, в которых силы притяжения и отталкивания со стороны соседних атомов уравновешены (рис. 79).

Рис. 79
В жидкости молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее, эти перескоки молекул являются причиной текучести жидкости, ее способности принимать форму сосуда.
В газах обычно расстояния между атомами и молекулами в среднем значительно больше размеров молекул. Силы отталкивания на больших расстояниях не действуют, поэтому газы легко сжимаются.
Практически отсутствуют между молекулами газа и силы притяжения, поэтому газы обладают свойством неограниченно расширяться.
Закономерности броуновского движения. Большое значение в обосновании молекулярно-кинетической теории имело открытие английского ботаника Роберта Броуна (1773-1858). В 1827 г. он обнаружил беспорядочное движение видимых в микроскоп твердых частиц, находящихся в жидкости. Это явление, названное броуновским движением, смогла объяснить лишь молекулярно-кинетическая теория на основе использования представлений о существовании молекул. Беспорядочно движущиеся молекулы жидкости или газа сталкиваются с твердой частицей и изменяют направление и модуль скорости ее движения. Число молекул, ударяющих частицу с различных сторон, и направление передаваемого ими импульса непостоянны. Чем меньше размеры и масса частицы, тем более заметными становятся изменения ее импульса во времени.
Французский ученый Жан Перрен (1870-1942) в 1908-1911 гг. выполнил серию экспериментов по изучению броуновского движения. Пример результатов одного из наблюдений за движением броуновской частицы представлен на рисунке 80. Закономерности броуновского движения, предсказанные на основе молекулярно-кинетической теории, полностью подтвердились этими экспериментами.

Рис. 80
Измерение скорости молекул. Одним из первых экспериментов, в котором были непосредственно измерены скорости движения отдельных молекул газа, был опыт, выполненный немецким физиком Отто Штерном (1888-1969) в 1920 г.
В опыте использовался прибор, состоящий из двух цилиндров с общей осью вращения. По оси цилиндра была расположена платиновая проволока, покрытая серебром. Воздух из пространства между цилиндрами откачивался.
При пропускании электрического тока через проволоку в результате ее нагревания происходило испарение атомов серебра с поверхности проволоки. Во внутреннем цилиндре имелась щель, атомы серебра пролетали через нее и оседали на внутренней стенке второго цилиндра, образуя на ней заметную полоску.
Когда цилиндры приводились во вращение с одинаковой частотой, полоска оказывалась в другом месте. По углу  между этими двумя положениями полоски (рис. 81), расстоянию
между этими двумя положениями полоски (рис. 81), расстоянию  и частоте
и частоте  вращения цилиндров можно было определить скорость атомов серебра:
вращения цилиндров можно было определить скорость атомов серебра:
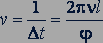
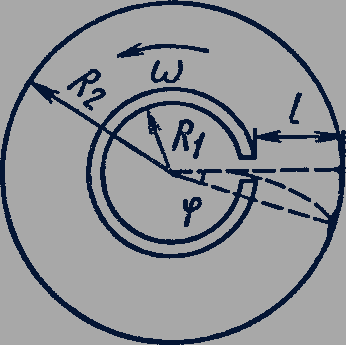
Рис. 81
Полоска серебра, получившаяся при вращении цилиндров, оказалась размытой. Это свидетельствовало о том, что атомы серебра, испаряющиеся с проволоки, имеют различные скорости. Найденные из таких измерений значения скорости движения атомов серебра оказались совпадающими со значениями, полученными на основе молекулярно-кинетической теории. Это совпадение является одним из важнейших прямых доказательств справедливости молекулярно-кинетической теории газов.
Наблюдения отдельных атомов. В настоящее время основные положения молекулярно-кинетической теории подтверждаются многочисленными опытами с использованием достижений современной экспериментальной техники. С помощью ионного проектора получают изображения кристаллов, по которым можно представить их строение. Электронные микроскопы позволили получить изображения, по которым оказалось возможным определение расстояния между отдельными атомами в молекуле.
Количество вещества. Любое вещество состоит из частиц, поэтому количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, содержащей столько же частиц, сколько содержится атомов в 0,012 кг углерода12С.
Отношение числа молекул 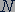 вещества к количеству вещества
вещества к количеству вещества  называется постоянной Авогадро
называется постоянной Авогадро 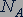 :
:
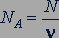 (23.1)
(23.1)
Постоянная Авогадро равна 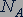 = 6,022·1023 моль-1, она показывает, сколько атомов или молекул содержится в одном моле вещества.
= 6,022·1023 моль-1, она показывает, сколько атомов или молекул содержится в одном моле вещества.
Количество вещества  можно найти как отношение числа
можно найти как отношение числа 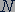 атомов или молекул вещества к постоянной Авогадро
атомов или молекул вещества к постоянной Авогадро 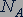 :
:
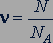 . (23.2)
. (23.2)
Молярная масса. Молярной массой 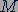 называется величина, равная отношению массы вещества
называется величина, равная отношению массы вещества 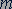 к количеству вещества
к количеству вещества  :
:
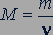 (23.3).
(23.3).
Молярная масса выражается в килограммах на моль (кг/моль).
Молярную массу вещества можно найти путем определения количества вещества при известной массе вещества. Подставив уравнение (23.2) в уравнение (23.3), молярную массу 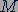 вещества можно выразить через массу молекулы
вещества можно выразить через массу молекулы 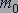 :
:
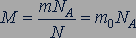 (23.4)
(23.4)
Масса молекул. Для определения массы молекулы 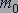 нужно разделить массу
нужно разделить массу 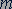 вещества на число
вещества на число 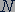 молекул в нем:
молекул в нем:
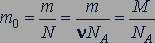 (23.5)
(23.5)
Таким образом, чтобы найти массу молекулы вещества, нужно знать молярную массу вещества 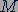 и постоянную Авогадро
и постоянную Авогадро 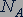 . Молярная масса вещества обычно определяется химическими методами, постоянная Авогадро с высокой степенью точности определена несколькими физическими методами.
. Молярная масса вещества обычно определяется химическими методами, постоянная Авогадро с высокой степенью точности определена несколькими физическими методами.
Значительно более высокая точность определения масс атомов и молекул достигается при использовании масс-спектрометра. Масс-спектрометр - это прибор, в котором с помощью электрических и магнитных полей происходит разделение пучков заряженных частиц (ионов) в пространстве в зависимости от их массы и заряда.
24. ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ИДЕАЛЬНОГО ГАЗА
Идеальный газ. Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. В модели идеального газа предполагается следующее: молекулы обладают пренебрежимо малым объемом по сравнению с объемом сосуда, между молекулами не действуют силы притяжения, при соударениях молекул друг с другом и со стенками сосуда действуют силы отталкивания.
Давление идеального газа. Одним из первых и важных успехов молекулярно-кинетической теории было качественное и количественное объяснение явления давления газа на стенки сосуда.
Качественное объяснение давления газа заключается в том, что молекулы идеального газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела. При столкновении молекулы со стенкой сосуда проекция 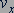 вектора скорости на ось 𝑂𝑋, перпендикулярную стенке, изменяет свой знак на противоположный, но остается постоянной по модулю (рис. 82). Поэтому в результате столкновения молекулы со стенкой проекция ее импульса на ось 𝑂𝑋 изменяется от
вектора скорости на ось 𝑂𝑋, перпендикулярную стенке, изменяет свой знак на противоположный, но остается постоянной по модулю (рис. 82). Поэтому в результате столкновения молекулы со стенкой проекция ее импульса на ось 𝑂𝑋 изменяется от  до
до  .
.

Рис. 82
Изменение импульса молекулы показывает, что на нее при столкновении действует сила 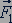 , направленная от стенки. Изменение импульса молекулы равно импульсу силы
, направленная от стенки. Изменение импульса молекулы равно импульсу силы 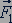 :
:
 .
.
Во время столкновения молекула действует на стенку с силой 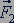 , равной по третьему закону Ньютона силе
, равной по третьему закону Ньютона силе 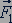 по модулю и направленной противоположно.
по модулю и направленной противоположно.
Молекул газа очень много, и удары их о стенку следуют один за другим с очень большой частотой. Среднее значение геометрической суммы сил, действующих со стороны отдельных молекул при их столкновениях со стенкой сосуда, и является силой давления газа. Давление газа равно отношению модуля силы давления  к площади стенки
к площади стенки  :
:
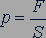
На основе использования основных положений молекулярно-кинетической теории было получено уравнение, которое позволяло вычислить давление газа, если известны масса 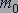 молекулы газа, среднее значение квадрата скорости молекул
молекулы газа, среднее значение квадрата скорости молекул 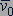 и концентрация
и концентрация  молекул:
молекул:
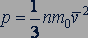 (24.1)
(24.1)
Уравнение (24.1) называют основным уравнением молекулярно-кинетической теории.
Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа 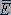 :
:

получим
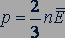 (24.2)
(24.2)
Давление идеального газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
25. ТЕМПЕРАТУРА - МЕРА СРЕДНЕЙ КИНЕТИЧЕСКОЙ ЭНЕРГИИ МОЛЕКУЛ
Температура. Основное уравнение молекулярно-кинетической теории для идеального газа устанавливает связь легко измеряемого макроскопического параметра - давления - с такими микроскопическими параметрами газа, как средняя кинетическая энергия и концентрация молекул.
Но, измерив только давление газа, мы не можем узнать ни среднее значение кинетической энергии молекул в отдельности, ни их концентрацию. Следовательно, для нахождения, микроскопических параметров газа нужны измерения еще какой-то физической величины, связанной со средней кинетической энергией молекул. Такой величиной в физике является температура.
Из повседневного опыта каждый знает, что бывают тела горячие и холодные. При контакте двух тел, из которых одно мы воспринимаем как горячее, а другое - как холодное, происходят изменения физических параметров как первого, так и второго тела. Например, твердые и жидкие тела обычно при нагревании расширяются. Через некоторое время после установления контакта между телами изменения макроскопических параметров тел прекращаются. Такое состояние тел называется тепловым равновесием. Физический параметр, одинаковый во всех частях системы тел, находящихся в состоянии теплового равновесия, называется температурой тела. Если при контакте двух тел никакие их физические параметры, например объем, давление, не изменяются, то между телами нет теплопередачи и температура тел одинакова.
Термометры. В повседневной практике наиболее распространен способ измерения температуры с помощью жидкостного термометра.
В устройстве жидкостного термометра используется свойство расширения жидкостей при нагревании. В качестве рабочего тела обычно применяется ртуть, спирт, глицерин. Чтобы измерить температуру тела, термометр приводят в контакт с этим телом; между телом и термометром будет осуществляться теплопередача до установления теплового равновесия. Масса термометра должна быть значительно меньше массы тела, так как в противном случае процесс измерения может существенно изменить температуру тела.
Изменения объема жидкости в термометре прекращаются, когда между телом и термометром прекращается теплообмен. При этом температура жидкости в термометре равна температуре тела.
Отметив на трубке термометра положение конца столба жидкости при помещении термометра в тающий лед, а затем в кипящую воду при нормальном давлении и разделив отрезок между этими отметками на 100 равных частей, получают температурную шкалу по Цельсию. Температура тающего льда принимается равной 0 °С (рис. 83), кипящей воды - 100 °С (рис. 84). Изменение длины столба жидкости в термометре на одну сотую длины между отметками 0 и 100 °С соответствует изменению температуры на 1 °С.
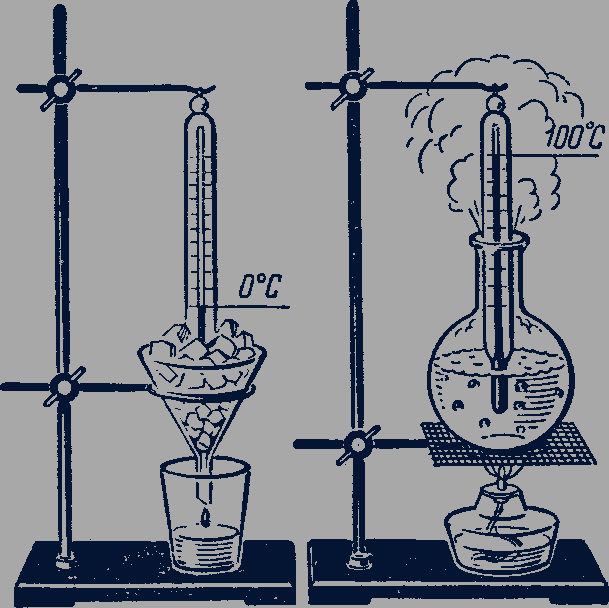
Рис. 83-84
Существенным недостатком способа измерения температуры с помощью жидкостных термометров является то, что шкала температуры при этом оказывается связанной с конкретными физическими свойствами определенного вещества, используемого в качестве рабочего тела в термометре, - ртути, глицерина, спирта. Изменение объема различных жидкостей при одинаковом нагревании оказывается несколько различным. Поэтому ртутный и глицериновый термометры, показания которых совпадают при 0 и 100 °С, дают разные показания при других температурах.
Газы в состоянии теплового равновесия. Для того чтобы найти более совершенный способ определения температуры, нужно найти такую величину, которая была бы одинаковой для любых тел, находящихся в состоянии теплового равновесия.
Экспериментальные исследования свойств газов показали, что для любых газов, находящихся в состоянии теплового равновесия, отношение произведения давления газа на его объем к числу молекул оказывается одинаковым:
 . (25.1)
. (25.1)
Этот опытный факт позволяет принять величину  в качестве естественной меры температуры.
в качестве естественной меры температуры.
Так как 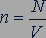 , то с учетом основного уравнения молекулярно-кинетической теории (24.2) получим
, то с учетом основного уравнения молекулярно-кинетической теории (24.2) получим
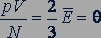 . (25.2)
. (25.2)
Следовательно, средняя кинетическая энергия молекул любых газов, находящихся в тепловом равновесии, одинакова. Величина  равна двум третям средней кинетической энергии беспорядочного теплового движения молекул газа и выражается в джоулях.
равна двум третям средней кинетической энергии беспорядочного теплового движения молекул газа и выражается в джоулях.
В физике обычно выражают температуру в градусах, принимая, что температура 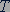 в градусах и величина
в градусах и величина  связаны уравнением
связаны уравнением
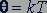 , (25.3)
, (25.3)
где 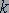 - коэффициент пропорциональности, зависящий от выбора единицы температуры.
- коэффициент пропорциональности, зависящий от выбора единицы температуры.
Отсюда получаем
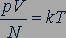 . (25.4)
. (25.4)
Последнее уравнение показывает, что имеется возможность выбрать температурную шкалу, не зависящую от природы газа, используемого в качестве рабочего тела.
Практически измерение температуры на основании использования уравнения (25.4) осуществляется с помощью газового термометра (рис. 85). Устройство его таково: в сосуде постоянного объема находится газ, количество газа остается неизменным. При постоянных значениях объема  и числа молекул
и числа молекул  давление газа, измеряемое манометром, может служить мерой температуры газа, а значит, и любого тела, с которым газ находится в тепловом равновесии.
давление газа, измеряемое манометром, может служить мерой температуры газа, а значит, и любого тела, с которым газ находится в тепловом равновесии.
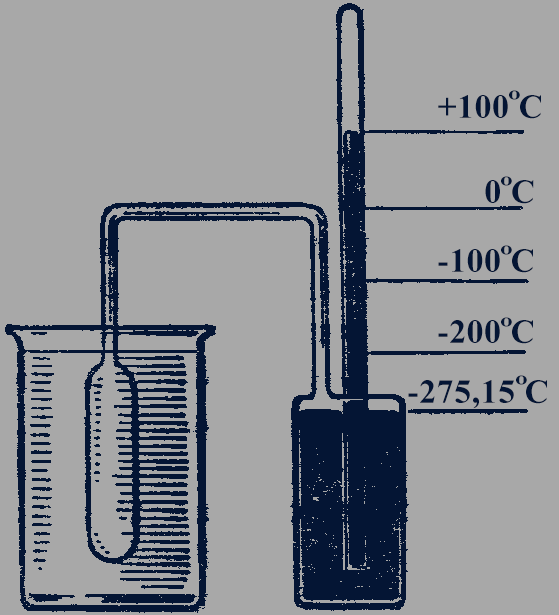
Рис. 85
Абсолютная шкала температур. Шкала измерения температуры в соответствии с уравнением (25.4) называется абсолютной шкалой. Ее предложил английский физик У. Кельвин (Томсон) (1824-1907), поэтому шкалу называют также шкалой Кельвина.
До введения абсолютной шкалы температур в практике получила широкое распространение шкала измерения температуры по Цельсию. Поэтому единица температуры по абсолютной шкале, называемая Кельвином (К), выбрана равной одному градусу по шкале Цельсия:
1 К = 1 °С. (25.5)
Абсолютный нуль температуры. В левой части уравнения (25.4) все величины могут иметь только положительные значения или быть равными нулю. Поэтому абсолютная температура  может быть только положительной или равной нулю. Температура, при которой давление идеального газа при постоянном объеме должно быть равно нулю, называется абсолютным нулем температуры.
может быть только положительной или равной нулю. Температура, при которой давление идеального газа при постоянном объеме должно быть равно нулю, называется абсолютным нулем температуры.
Постоянная Больцмана. Значение постоянной 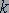 в уравнении (25.4) можно найти по известным значениям давления и объема газа с известным числом молекул
в уравнении (25.4) можно найти по известным значениям давления и объема газа с известным числом молекул 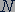 при двух значениях температуры
при двух значениях температуры 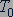 и
и 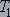 :
:
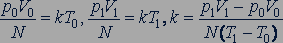 (25.6)
(25.6)
Как известно, 1 моль любого газа содержит примерно 6,022·1023 молекул и при нормальном давлении  = 1,013·105 Па занимает объем
= 1,013·105 Па занимает объем  =2,24·10-2 м3.
=2,24·10-2 м3.
Опыты показали, что при нагревании любого газа при постоянном объеме от 0 до 100° С его давление возрастает от 1,013·105 до 1,38·105 Па. Подставляя эти значения в уравнение (25.6), получаем
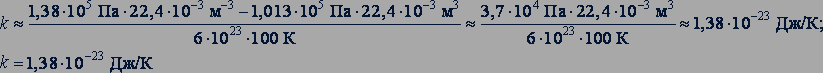
Коэффициент 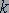 называется постоянной Больцмана, в честь австрийского физика Людвига Больцмана (1844-1906), одного из создателей молекулярно-кинетической теории.
называется постоянной Больцмана, в честь австрийского физика Людвига Больцмана (1844-1906), одного из создателей молекулярно-кинетической теории.
Связь абсолютной шкалы и шкалы Цельсия. Уравнение (25.4) позволяет по известному значению объема  одного моля газа при температуре 0 °С и нормальном давлении 1,013·105 Па и найденному значению постоянной Больцмана установить связь между значениями температуры
одного моля газа при температуре 0 °С и нормальном давлении 1,013·105 Па и найденному значению постоянной Больцмана установить связь между значениями температуры  по шкале Цельсия и температуры
по шкале Цельсия и температуры  по абсолютной шкале. При температуре 0 °С температура
по абсолютной шкале. При температуре 0 °С температура  по абсолютной шкале равна
по абсолютной шкале равна

Мы получили, что температура 0 °С по шкале Цельсия соответствует температуре 273 К по абсолютной шкале.
Так как единица температуры по абсолютной шкале 1 К выбрана равной единице температуры по шкале Цельсия 1 °С, то при любой температуре  по Цельсию значение абсолютной температуры
по Цельсию значение абсолютной температуры  выше на 273 градуса:
выше на 273 градуса:
 . (25.7)
. (25.7)
Из уравнения (25.7) следует, что абсолютный нуль соответствует - 273 °С (более точно, - 273,15 °С). Соответствие шкалы Цельсия и абсолютной шкалы температур представлено на рисунке 86.
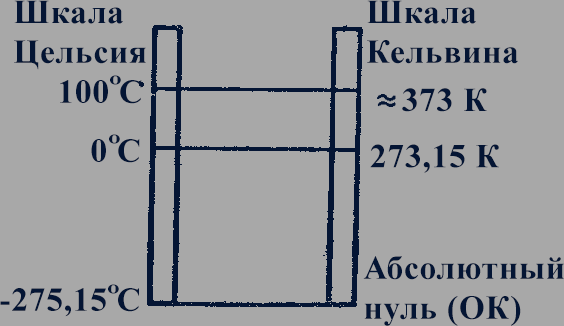
Рис. 86
Температура - мера средней кинетической энергии молекул. Из уравнений (25.2) и (25.4) следует равенство
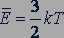 (25.8)
(25.8)
Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре.
Из уравнений (24.2) и (25.8) можно получить, что
 . (25.9)
. (25.9)
Уравнение (25.9) показывает, что при одинаковых значениях температуры и концентрации молекул давление любых газов одинаково, независимо от того, из каких молекул они состоят.
26. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Используя зависимость давления идеального газа от его температуры и концентрации молекул
 ,
,
можно найти связь между основными макроскопическими параметрами газа - объемом 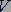 , его давлением
, его давлением 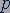 и температурой
и температурой 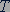 .
.
Концентрация  молекул газа равна
молекул газа равна
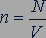 , (26.1)
, (26.1)
где 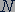 - число молекул газа в сосуде объемом
- число молекул газа в сосуде объемом 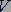 . Число
. Число 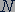 можно выразить как произведение количества вещества
можно выразить как произведение количества вещества  на постоянную Авогадро
на постоянную Авогадро 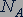 :
:
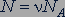 . (26.2)
. (26.2)
Из выражений (25.9), (26.1) и (26.2) получаем
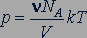 . (26.3)
. (26.3)
Произведение постоянной Авогадро 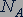 на постоянную Больцмана
на постоянную Больцмана 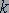 называется молярной газовой постоянной
называется молярной газовой постоянной 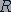 . Молярная газовая постоянная равна
. Молярная газовая постоянная равна
 . (26.4)
. (26.4)
Используя молярную газовую постоянную, выражение (26.3) преобразуем в уравнение
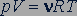 . (26.5)
. (26.5)
Количество вещества  можно найти, зная массу вещества
можно найти, зная массу вещества 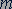 и его молярную массу
и его молярную массу 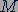 :
:
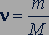 , (26.6)
, (26.6)
поэтому уравнение (26.5) можно записать в такой форме:
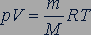 . (26.7)
. (26.7)
Это уравнение называется уравнением состояния идеального газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газов, было получено французским физиком Бенуа Клапейроном (1799-1864). В форме (26.7) его впервые применил великий русский ученый Дмитрий Иванович Менделеев (1834-1907), поэтому уравнение состояния газа называется уравнением Менделеева - Клапейрона.
Для исследования связи между объемом, давлением и температурой газа можно использовать герметичный сосуд, объем которого может изменяться. Внешний вид такого прибора - сильфона - представлен на рисунке 87.
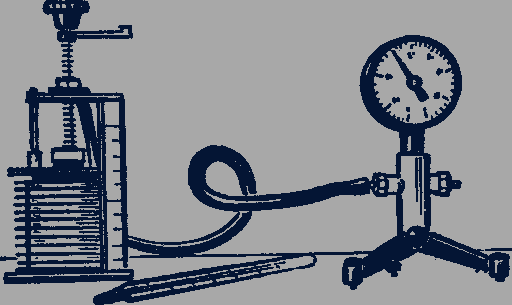
Рис. 87
Изопроцессы в газах. Уравнение (26.7) показывает, что возможно одновременное изменение пяти параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра из пяти. Особую роль в физике и технике играют три процесса - изотермический, изохорный и изобарный. Рассмотрим эти процессы.
Изотермический процесс. Изотермическим процессом называется процесс, протекающий при постоянной температуре 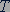 . Из уравнения состояния идеального газа (26.7) следует, что при постоянной температуре
. Из уравнения состояния идеального газа (26.7) следует, что при постоянной температуре  и неизменных значениях массы газа и его молярной массы
и неизменных значениях массы газа и его молярной массы 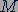 произведение давления
произведение давления 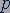 газа на его объем
газа на его объем  должно оставаться постоянным:
должно оставаться постоянным:
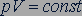 . (26.8)
. (26.8)
Изотермический процесс можно осуществить, например, путем изменения объема газа при постоянной температуре.
График изотермического процесса называется изотермой. Изотерма, изображенная в прямоугольной системе координат, по оси ординат которой отсчитывается давление газа, а по оси абсцисс - его объем, является гиперболой (рис. 88).
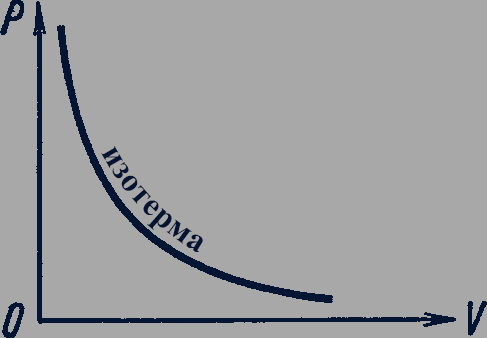
Рис. 88
Уравнение (26.8), устанавливающее связь между давлением и объемом газа при постоянной температуре, было получено из эксперимента до создания молекулярно-кинетической теории газов в 1662 г. английским физиком Робертом Бойлем (1627-1691) и в 1676 г. французским физиком Эдмом Мариоттом (1620-1684). Поэтому это уравнение называют законом Бойля - Мариотта.
⇦ Ctrl предыдущая страница / следующая страница Ctrl ⇨
МЕНЮ САЙТА / СОДЕРЖАНИЕ